 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
将下列氧化还原反应设计成为两个半电池反应,并利用标准电极电势表的数据,求出298K时反应的平衡常数。
将下列氧化还原反应设计成为两个半电池反应,并利用标准电极电势表的数据,求出298K时反应的平衡常数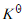 。
。
 答案
答案
查看答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
将下列氧化还原反应设计成为两个半电池反应,并利用标准电极电势表的数据,求出298K时反应的平衡常数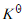 。
。
 答案
答案
 更多“将下列氧化还原反应设计成为两个半电池反应,并利用标准电极电势表的数据,求出298K时反应的平衡常数。”相关的问题
更多“将下列氧化还原反应设计成为两个半电池反应,并利用标准电极电势表的数据,求出298K时反应的平衡常数。”相关的问题
第4题
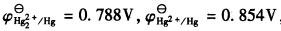 ,试计算:(1)反应Hg2++2e→
,试计算:(1)反应Hg2++2e→
 Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
第5题
 2Mn2++5Cl2+8H2O (1)试将反应拆分成两个电极反应,写出电池符号,并判断标准状态下此反应进行的方向。 (2)若c(H+)=0.0100mol.L—1,p(Cl2)=1000kPa,其他离子浓度为1.00mol.L—1,求此电池在298K时的电动势,并判断反应方向。 (3)求此反应的标准平衡常数。
2Mn2++5Cl2+8H2O (1)试将反应拆分成两个电极反应,写出电池符号,并判断标准状态下此反应进行的方向。 (2)若c(H+)=0.0100mol.L—1,p(Cl2)=1000kPa,其他离子浓度为1.00mol.L—1,求此电池在298K时的电动势,并判断反应方向。 (3)求此反应的标准平衡常数。
第6题
已知298K时下列半反应的标准电极电势:

第8题
已知298K时下列半反应的标准电极电势:
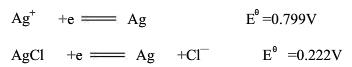
试求AgCl的溶度积常数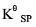 。
。
第9题
试为下述反应设计一电池
Cd(s)+I2(s)====Cd2+(a=1)+2I-(a=1)
求电池在298K时的标准电动势E、反应的△rG和平衡常数Kθ。