 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。(1)求t1/2;(2
N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。(1)求t1/2;(2)若反应在密闭容器中进行,反应开始时容器中只充有N2O5,其压力为66.66kPa,求反应开始后10秒和10分钟时的压力。
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。(1)求t1/2;(2)若反应在密闭容器中进行,反应开始时容器中只充有N2O5,其压力为66.66kPa,求反应开始后10秒和10分钟时的压力。
 答案
答案
 更多“N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。(1)求t1/2;(2”相关的问题
更多“N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。(1)求t1/2;(2”相关的问题
第1题
N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。

第2题
在318.15K时,已知CCl4溶液中N2O5的分解反应:
2N2O5→4NO2+O2
为一级反应。
(1)当N2O5的起始浓度c0(N2O5)=0.50mol·L-1时,测得其起始反应速率为υ0=3.25×10-4mol·L-1·min-1,求该反应的转化率。
第3题
已知65℃时N2O5气相分解反应速率常数的单位是min-1,半衰期为2.37min,反应的活化能为103.3kJ·mol-1,求80℃时的速率常数。
第4题
N2O5(g)→N2O4(g)+(1/2)O2(g)为一级反应。在25℃时,反应速率常数为0.0010min-1。同温度下产物N2O4能分解成NO2(g),并很快达平衡:N2O4(g) 2NO2(g),反应平衡常数
2NO2(g),反应平衡常数
第6题
298K时,N2O5(g)====N2O4(g)+
(1) 该反应的速率常数;
(2) N2O5(g)转化掉90%所需的时间。
第7题
应在323.15K温度下的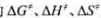 。
。

第8题
298 K时,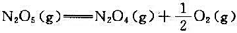 ,该分解反应的半衰期t1/2=5. 7 h,此值与N2O5(g)的起始浓度无关。试求:(1)该反应的速率常数;(2) N2O5(g)转化掉90%所需的时间。
,该分解反应的半衰期t1/2=5. 7 h,此值与N2O5(g)的起始浓度无关。试求:(1)该反应的速率常数;(2) N2O5(g)转化掉90%所需的时间。
第9题
N2O5的分解反应是2N2O5→4NO2+O2,由实验测得在67℃时N2O5的浓度随时间的变化如下:
 试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
第10题
30. 65℃时N2O5气相分解的速率常数为0.292min-1,活化能为103.3kJ·mol-1,求80℃时的k和t1/2。